Blutproben
Der Patient sollte nach Möglichkeit 6 bis 12 Stunden vor der Blutentnahme keine Nahrung zu sich nehmen und keinen starken körperlichen Belastungen ausgesetzt sein um Störfaktoren zu vermeiden – oft eine Wunschvorstellung im Veterinärbereich und bei Pflanzenfressern meist auch nicht angestrebt. Werte wie Glukose, Cholesterin oder Cortisol können durch vorherige Nahrungsaufnahme aber physiologisch erhöht sein.
Welches Material wird für welche Untersuchung benötigt?
Nicht jedes Untersuchungsmaterial eignet sich auch für die ausgewählte Leistung, deshalb sollte im Vorfeld klar sein, welche Parameter bestimmt werden sollen.
Im VETSCREEN Leistungsverzeichnis sowie in den Anforderungsbögen wird bei jeder Leistung angegeben, welches Material und welche Probenmenge für die jeweilige Untersuchung benötigt wird.
Wird Serum oder Plasma benötigt, sollte nach Möglichkeit die Probe ca. 5 min. bei 3500 Umdrehungen pro Minute in der Praxis zentrifugiert werden. Der Überstand wird abpipettiert und in ein separates, unbeschichtetes Gefäß überführt. Für die Gewinnung von Serum ist zu beachten, dass die Gerinnung (Probe 1-2 Stunden stehen lassen) vor dem Zentrifugieren abgeschlossen sein sollte. Wenn es nicht möglich ist die Probe zu zentrifugieren, kann diese auch nach der Blutentnahme 1-2 Stunden in den Kühlschrank gestellt werden, bis sich die zellulären Bestandteile absetzen. Bei Hund und Katze funktioniert das allerdings nur schwer bzw. kaum. Danach kann der Überstand (Serum bzw. Plasma) in ein neues Röhrchen abpipettiert werden.
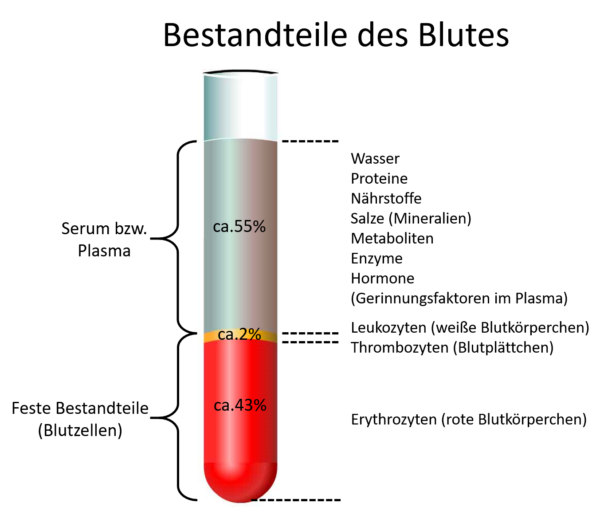

Serum ist der zellfreie Überstand einer geronnenen Blutprobe und enthält somit keine Gerinnungsfaktoren (Fibrin bzw. Fibrinogen) mehr. Serum-Röhrchen sind an der Innenwand mit einem Gerinnungsbeschleuniger beschichtet. Es eignet sich am besten für die Bestimmung der klinisch-chemischen Parameter sowie für Hormon- und Antikörperbestimmungen. Für Erstgenannte ist Serum immer vorzuziehen, da einige Werte, wie z.B. Kalium (K), Calcium (Ca), Magnesium (Mg), Eisen (Fe), Alkalische Phophatase (AP), Insulin und Fructosamine nur aus Serumproben bestimmt werden können.
BITTE BEACHTEN: Wird als Untersuchungsmaterial „1ml Serum“ benötigt, so ist reines Serum gemeint, kein Vollblut!! (→ 3ml Vollblut ergeben ca. 1ml Serum)
Die nachfolgenden Röhrchen sind an der Innenwand mit einem Gerinnungshemmer beschichtet.
EDTA-Blut ist für die hämatologischen Untersuchungen, wie z.B. das Blutbild, Thrombozyten und Blutgruppen, aber auch für PCR-Untersuchungen erforderlich. Das (EDTA-)Plasma (zellfreier Überstand einer Blutprobe, die ungerinnbar gemacht wurde) eignet sich für die Bestimmung von verschiedenen klinisch-chemischen Parametern und Antikörpern und ist für einige Leistungen sogar zwingend erforderlich (z.B. ACTH, NT-proBNP).
Beachten Sie bitte, dass EDTA die mögliche Anzahl der zu untersuchenden Parameter einschränkt.
Lithium-Heparin-Blut (LiHep-Blut) eignet sich fast uneingeschränkt für die Bestimmung von klinisch-chemischen Parametern, Hormonen und Antikörpern sowie für die Hämatologie. Von daher wird es gerne bei kleinen oder unkooperativen Tieren verwendet, die nur wenig Blut geben.
Natrium-Fluorid-Blut (NaF-Blut) wird ausschließlich für die Glukose- und Laktatbestimmung benötigt.
Citrat-Blut wird nur für die Gerinnungsdiagnostik benötigt. Für diese Untersuchungen muss ein Mischungsverhältnis von 1:10 (1 Teil Natrium-Citrat + 9 Teile Blut) eingesetzt werden. Werden kommerzielle Röhrchen mit Citrat-Vorgabe benutzt, so ist der Markierungsstrich für die Füllhöhe unbedingt zu berücksichtigen! Citrat-Röhrchen und Untersuchungen zur Gerinnungsdiagnostik können Sie bei uns gerne auf Nachfrage erhalten.
BITTE BEACHTEN: Um die Bildung von Mikrogerinnseln zu vermeiden, muss die Probe nach dem Befüllen vorsichtig aber gut geschwenkt werden, um so das Durchmischen des Blutes mit den im Röhrchen enthaltenen Substanzen zu gewährleisten.
Blutausstriche
Bereits wenige Stunden nach der Blutentnahme tritt eine Zellalterung ein, daher sollte zur korrekten Beurteilung des Differenzialblutbildes am besten auch ein Blutausstrich mitgeschickt werden. Dieser ist ebenfalls zum Nachweis von Blutparasiten und hämotropen Mykoplasmen erforderlich.
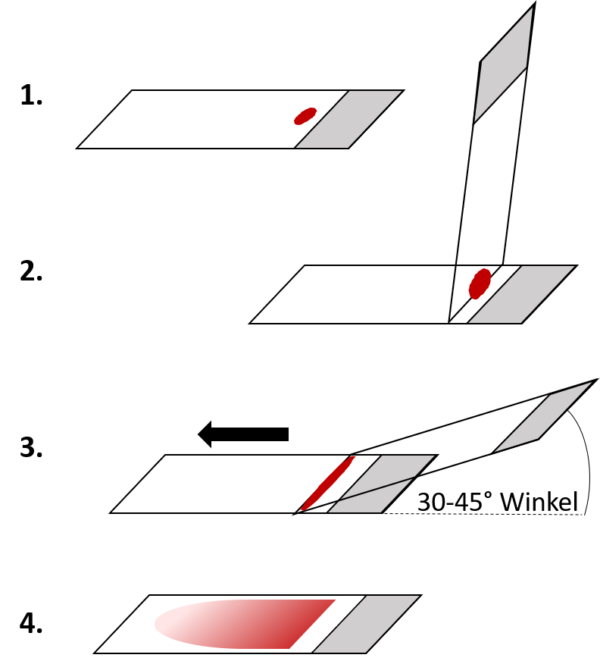
- einen Tropfen Blut auf das Ende eines Objektträgers geben
- ein Deckgläschen oder Objektträger mit geschliffenen Kanten im 45°-Winkel auf den Objektträger aufsetzen und an den Blutstropfen heranführen
- Tropfen am Deckglas/Objektträger verteilen lassen; Deckglas/Objektträger in einem Winkel von 30 – 45° zügig über den Objektträger schieben und dabei das Blut hinterher ziehen
- Ausstrich lufttrocknen lassen
Wichtig: der Ausstrich sollte
- gleichmäßig sein
- zum ausgestrichenen Ende hin dünner werden
- halbrund auslaufen
Störfaktoren, die zu einer Verfälschung der Ergebnisse führen können
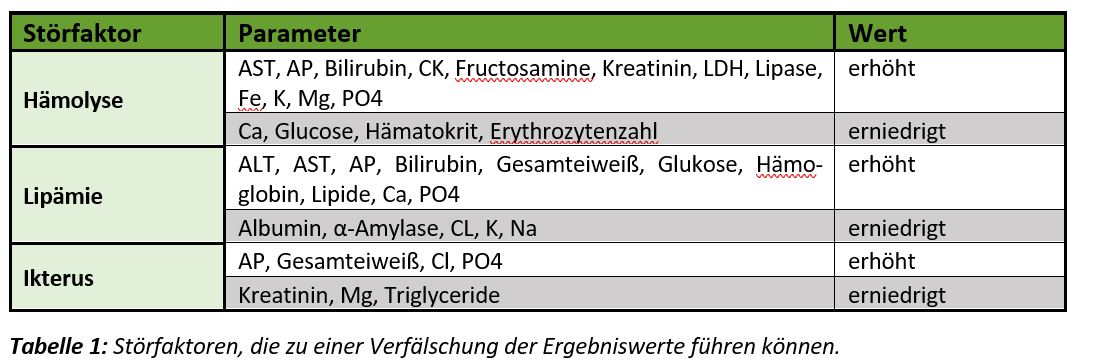
Falls nicht vermeidbar, müssen Störfaktoren wie Hämolyse, Lipämie oder Ikterus bei der Interpretation der Ergebnisse berücksichtigt werden (s. Tabelle 1).
Hämolyse (Schädigung und infolgedessen Auflösung der roten Blutkörperchen) wird meist verursacht während der Probenentnahme oder deren Weiterverarbeitung und ist nur selten krankheitsbedingt. Zur Vermeidung sollte die Vene vor Punktion nur kurzzeitig gestaut werden. Während der Blutentnahme muss ein zu starker Unterdruck in der Spritze vermieden werden um eine Schädigung der Erythrozyten zu verhindern. Wird für die gewünschte Leistung nur Serum/Plasma benötigt, ist es empfehlenswert vor dem Versand den zellfreien Überstand vom Blutkuchen zu trennen. Vollblut sollte nach Möglichkeit nicht versendet werden, da es während des Transportes leicht zu einer Zellschädigung und somit zu einem hämolytischen Serum kommen könnte.
Lipämie (weißliche Trübung des Blutserums/-plasmas) deutet auf fetthaltiges Blut hin. Erhöhte Blutfette liegen in der Regel fütterungsbedingt (oder auch durch starke Belastung) vor und können durch Fasten (6-12 Std.) vor Blutentnahme vermieden werden, sofern dies der Gesundheitszustand des Patienten zulässt.
BITTE BEACHTEN: Keinesfalls darf dem Tier der Zugang zu ausreichend Trinkwasser verwehrt werden!
Ikterus (Gallenfarbstoffe im Blut), oder auch Gelbsucht genannt, ist in der Regel krankheitsbedingt und nicht beeinflussbar.
Lagerung der Blutproben bis zum Transport:
Raumtemperatur
Für die meisten Laboruntersuchungen in Blut, Serum oder Plasma ist die Stabilität einer lichtgeschützten Lagerung bei Raumtemperatur bis zur Abholung oder Versendung ausreichend.
EDTA-Proben für hämatologische Untersuchungen, wie z.B. Blutbilder, sollten stets bei normaler Raumtemperatur gelagert und nicht gekühlt werden. Gleiches gilt für die kurzfristige Lagerung (< 4 Stunden) von Citratblut-Röhrchen für Gerinnungsuntersuchungen.
Kühlschrank (2 bis 8°C)
Darüber hinaus ist mit sehr wenigen Ausnahmen die Lagerung von Serumproben und zentrifugierten Vacutainer-Röhrchen im Kühlschrank zu empfehlen.
Tiefkühlen
Bei einigen Analyten ist eine tiefgefrorene Lagerung der Serum- oder Plasmaprobe nötig. Dies gilt vor allem für Proben, die nicht binnen kurzer Frist in das Labor transportiert werden. Im Leistungsverzeichnis sind solche Proben mit „gekühlt“ bezeichnet. Somit ist das abgetrennte Serum oder Plasma unmittelbar nach der Zentrifugation und Überführung in ein separates Röhrchen einzufrieren. Beispiele für Laboruntersuchungen bei denen die Proben unmittelbar in das Labor transportiert oder tiefgefroren werden müssen: ACTH, pro-BNP, Insulin, ect.
Tiefgefrorene Proben sollen zeitnah versendet werden. Bitte beim Kurierdienst, wenn vorhanden, anmelden und separat mit Kühl-Akkus oder einem sogenannten Versandbehälter für Kühltransport verpacken. (Alle mitgesendeten Behälter schicken wir kostenfrei wieder zurück.)
Achtung:
Das Tiefgefrieren einer Vollblutprobe führt zu einer vollständigen Hämolyse und macht diese unbrauchbar. Das abgetrennte Serum oder Plasma immer zuvor in separate, beschriftete Röhrchen überführen.
Serum und Plasma sind rein äußerlich nicht voneinander zu unterscheiden. Eine entsprechende Beschriftung ist deshalb erforderlich!
Serum-Gewinnung und Zentrifugation
Das Blut 30 Minuten ungekühlt, gut geschwenkt und lichtgeschützt gerinnen lassen.
Empfehlenswert für eine optimale Serumausbeute ist eine stehende Lagerung.
Danach 5 Minuten bei 3500 U/Min. zentrifugieren.
Fehler bei der Serumgewinnung
Zentrifugation zu früh
Erfolgt die Zentrifugation zu früh (nach weniger als 30 Minuten), kann die Gerinnung noch nicht vollständig abgelaufen sein. Dies hat eine Nachgerinnung des Serums zur Folge. Es entstehen Mikrogerinnsel oder das Serum geliert teilweise oder vollständig. Mikrogerinnsel und gelierte Seren können Analysen stören und zu falschen Laborergebnissen führen. Ein Serumgelee muss darüber hinaus im Labor manuell entfernt werden und führt zu Serumverlusten.
Zentrifugation zu spät
Erfolgt die Zentrifugation zu spät (nach mehr als 60 Minuten), kann dies zu Veränderungen von Laborwerten führen. Es kommt zum Beispiel zu einer Reduktion der Glucose und zu einem Anstieg des Kaliumspiegels.
Zu starke Rotation / zu hohe Umdrehungszahl bzw. g-Zahl
Bei zu hoher Geschwindigkeit des Rotors steigt die g-Zahl. Der Druck auf die Blutzellen wird zu stark. Es zerplatzen Erythrozyten und das Serum wird hämolytisch. Es kommt hierbei zu einem Übertritt von Kalium aus den Erythrozyten in das Serum. Die Hämolyse selbst kann Messverfahren beeinflussen und somit falsche Messergebnisse hervorrufen.
Zu geringe Drehzahl oder zu kurze Laufzeit der Zentrifuge
Bei zu geringer Drehzahl oder Laufzeit der Zentrifuge ist die Trennung von Serum und Blutzellen noch nicht vollständig. In vitro können sich Laborwerte verändern und Schwebeteilchen können Analysen stören.
Harnproben
Schicken Sie Urinproben bitte in sterilen und unbeschichteten Röhrchen ein. Die durch Blasenpunktion gewonnenen Harnproben (z.B. Katheterurin) sind Spontanurin vorzuziehen, da hier keine Verunreinigung mit Keimen aus den harnabführenden Wegen, der Körperoberfläche oder der Umwelt vorliegt. Bei der Bewertung der erstellten Befunde muss die Vorgehensweise der Probengewinnung berücksichtigt werden, sie ist deshalb vom Einsender dem Labor mitzuteilen. Wird eine kulturelle (bakteriologische) Harnuntersuchung gewünscht, wird empfohlen zusätzlich zum Urin ein Abstrich vom Harn (Tupfer mit Medium) mitzuschicken, da Urin keimtötende Eigenschaften besitzt.
Lagerung der Harnproben bis zum Transport:
Aufbereitung von Harnproben
Harnproben müssen in sauberen Behältnissen aufgefangen und gekühlt aufbewahrt werden. Die Qualität des Harns als Untersuchungsmaterials ist von der Abnahmetechnik abhängig. Man verwendet am besten Morgenurin, der beim Hund (Ausführen) und bei der Katze (Massieren) zumeist einfach, nötigenfalls auch portionsweise, gewonnen werden kann. Die Harngewinnung erfolgt bei Stute und Kuh durch Katheterisieren. Beim Hengst und Wallach ist man eher auf zufällig gewonnen Harn oder das Auffangen von abgesetzten Harn durch einen am Körper des Pferdes befestigten Harnbeutel angewiesen. Katheterharn darf nur mit sterilen Einmalkathetern entnommen werden. Bei der Hündin und bei Katzen wird Harn auch durch eine Punktion der Harnblase gewonnen.
Anschließend den Harn gut aufrühren und eine kleine Menge in unsere vorgesehene Urinbehälter zum Verschicken abfüllen.
Cortisol/Krea-Quotient
Für diese Untersuchung benötigen wir an zwei aufeinanderfolgenden Tagen abgefangenen Harn.
Achtung:
Hier bitte unbedingt Datum der Entnahme auf die Harnröhrchen notieren.
Transport
Nach vorschriftsmäßiger Abnahme des Morgenharns möglichst tagesgleicher, gekühlter Transport.
Ansonsten Lagerung im Kühlschrank bis 2-8°C, weil sich die Bakterien im Urin bei Raumtemperatur rasch vermehren können und dann zu falsch-positiven Ergebnissen führen.
Kotproben
Nach Möglichkeit sollte die Gewinnung der Proben mit wenig Kontamination erfolgen. Bei vom Boden aufgenommenen Kotproben besteht die Gefahr der Kontamination mit Umweltkeimen. Das Versandröhrchen (steriles, unbeschichtetes Kotröhrchen verwenden; am besten mit Schraubverschluss, da sich durch Gasbildung der Deckel öffnen könnte) sollte mindestens ¼, maximal ¾ gefüllt sein.
Für parasitologische Untersuchungen eignet sich am besten eine Sammelprobe von 3 aufeinanderfolgenden Kotabsätzen, da Parasiten nicht mit jedem Kotabsatz ausgeschieden werden.
Außerdem: Bitte darauf achten, dass eine Kotprobe nicht unter 7° Grad gelagert wird, da sonst ggf. Salmonellen absterben. Dies ist bei einem Darmflora-Screen, Großen/Kleinen Kot-Screen oder Durchfall-Screen relevant.
Da bei Vögeln die Probenmenge stets sehr gering ist und es dadurch zum Austrocknen des Probenmaterials kommen kann, wird die Einsendung eines Kloakentupfers in Transportmedium empfohlen. Sollte ein bisschen Kot an dem Abstrich vorhanden sein, können wir auch hier die parasitologische Untersuchung durchführen.
Tupferproben
Die Wahl des Tupfers richtet sich nach der gewünschten Untersuchung:
- Tupfer mit Transportmedium (Amies) für bakteriologische und mykologische Untersuchungen
Bakteriologische Untersuchungen:
Die Probenentnahme sollte am besten an Stellen erfolgen, die den Erreger mit großer Wahrscheinlichkeit enthalten. Bei eitrigen Entzündungen, Ohrentzündungen und Abszessen wird empfohlen, die Probe am Übergang vom kranken zum gesunden Gewebe zu entnehmen (nicht direkt aus dem Eiter, da dieser vorwiegend aus abgestorbenen Bakterien und Immunzellen besteht). Handelt es sich um eine sehr trockene Oberfläche, an der die Probe entnommen werden soll, so kann der Tupfer vorher mit steriler isotoner Kochsalzlösung angefeuchtet werden, das erleichtert die Probenaufnahme.
Mykologische Untersuchungen:
Sollen Hefen und/oder Schimmelpilzen kulturell nachgewiesen werden, gelten die gleichen Richtlinien zur Materialentnahme wie bei bakteriologischen Untersuchungen (s. oben). Zum Nachweis von Dermatophyten werden allerdings Hautgeschabsel oder Haare benötigt.
- Tupfer ohne Transportmedium für PCR-, virologische und parasitologische und Untersuchungen
Da für virologische Untersuchungen und Untersuchungen auf Chlamydien Zellmaterial gewonnen werden muss, sollten Eiter und andere Sekrete möglichst vor dem „Tupfern“ von der Schleimhaut entfernt werden. Anschließend wird beherzt getupft, um eine ausreichende Zellausbeute zu gewährleisten. Um sicher zu gehen, dass genug Zellmaterial eingeschickt wird, können auch gerne 2 Tupfer verwendet werden.
Hautgeschabsel und Haarproben
Zum Nachweis von Dermatophyten werden Hautgeschabsel oder Haare benötigt. Vor der Probenentnahme wird die Desinfektion der Entnahmestelle mit 70{850629d30786aecef0465c582c44699d7adb12b3e47487e90eff1bd32d4b5dcf}-igem Alkohol empfohlen, um eine potentielle Überwucherung der langsam wachsenden Pilzkulturen mit Bakterien zu beseitigen. Werden Haare eingeschickt, sollten diese an veränderten Hautstellen am Übergang zur gesunden Haut ausgezupft werden (abgeschnittene Haare sind nicht geeignet!).
Bei Verdacht auf Demodexmilben sind mindestens 5 tiefe Hautgeschabsel bis zum Austritt von Blut oder Gewebsflüssigkeit erforderlich oder die eitrig veränderten Haarfollikel müssen ausgepresst werden.
Stehen Sarcoptesmilben in Verdacht, sind verschiedene oberflächliche Hautgeschabsel empfehlenswert. Auch hier ist eine parasitologische Untersuchung möglich.
Je kleiner die eingesetzte Probenmenge ist, desto geringer ist die Nachweismöglichkeit von Hautpilzen oder Parasiten! Bitte achten Sie auf bruch- und verletzungssichere Verpackung und Versand.
Blutproben
Der Patient sollte nach Möglichkeit 6 bis 12 Stunden vor der Blutentnahme keine Nahrung zu sich nehmen und keinen starken körperlichen Belastungen ausgesetzt sein um Störfaktoren zu vermeiden – oft eine Wunschvorstellung im Veterinärbereich und bei Pflanzenfressern meist auch nicht angestrebt. Werte wie Glukose, Cholesterin oder Cortisol können durch vorherige Nahrungsaufnahme aber physiologisch erhöht sein.
Welches Material wird für welche Untersuchung benötigt?
Nicht jedes Untersuchungsmaterial eignet sich auch für die ausgewählte Leistung, deshalb sollte im Vorfeld klar sein, welche Parameter bestimmt werden sollen.
Im VETSCREEN Leistungsverzeichnis sowie in den Anforderungsbögen wird bei jeder Leistung angegeben, welches Material und welche Probenmenge für die jeweilige Untersuchung benötigt wird.
Wird Serum oder Plasma benötigt, sollte nach Möglichkeit die Probe ca. 5 min. bei 3500 Umdrehungen pro Minute in der Praxis zentrifugiert werden. Der Überstand wird abpipettiert und in ein separates, unbeschichtetes Gefäß überführt. Für die Gewinnung von Serum ist zu beachten, dass die Gerinnung (Probe 1-2 Stunden stehen lassen) vor dem Zentrifugieren abgeschlossen sein sollte. Wenn es nicht möglich ist die Probe zu zentrifugieren, kann diese auch nach der Blutentnahme 1-2 Stunden in den Kühlschrank gestellt werden, bis sich die zellulären Bestandteile absetzen. Bei Hund und Katze funktioniert das allerdings nur schwer bzw. kaum. Danach kann der Überstand (Serum bzw. Plasma) in ein neues Röhrchen abpipettiert werden.


Serum ist der zellfreie Überstand einer geronnenen Blutprobe und enthält somit keine Gerinnungsfaktoren (Fibrin bzw. Fibrinogen) mehr. Serum-Röhrchen sind an der Innenwand mit einem Gerinnungsbeschleuniger beschichtet. Es eignet sich am besten für die Bestimmung der klinisch-chemischen Parameter sowie für Hormon- und Antikörperbestimmungen. Für Erstgenannte ist Serum immer vorzuziehen, da einige Werte, wie z.B. Kalium (K), Calcium (Ca), Magnesium (Mg), Eisen (Fe), Alkalische Phophatase (AP), Insulin und Fructosamine nur aus Serumproben bestimmt werden können.
BITTE BEACHTEN: Wird als Untersuchungsmaterial „1ml Serum“ benötigt, so ist reines Serum gemeint, kein Vollblut!! (→ 3ml Vollblut ergeben ca. 1ml Serum)
Die nachfolgenden Röhrchen sind an der Innenwand mit einem Gerinnungshemmer beschichtet.
EDTA-Blut ist für die hämatologischen Untersuchungen, wie z.B. das Blutbild, Thrombozyten und Blutgruppen, aber auch für PCR-Untersuchungen erforderlich. Das (EDTA-)Plasma (zellfreier Überstand einer Blutprobe, die ungerinnbar gemacht wurde) eignet sich für die Bestimmung von verschiedenen klinisch-chemischen Parametern und Antikörpern und ist für einige Leistungen sogar zwingend erforderlich (z.B. ACTH, NT-proBNP).
Beachten Sie bitte, dass EDTA die mögliche Anzahl der zu untersuchenden Parameter einschränkt.
Lithium-Heparin-Blut (LiHep-Blut) eignet sich fast uneingeschränkt für die Bestimmung von klinisch-chemischen Parametern, Hormonen und Antikörpern sowie für die Hämatologie. Von daher wird es gerne bei kleinen oder unkooperativen Tieren verwendet, die nur wenig Blut geben.
Natrium-Fluorid-Blut (NaF-Blut) wird ausschließlich für die Glukose- und Laktatbestimmung benötigt.
Citrat-Blut wird nur für die Gerinnungsdiagnostik benötigt. Für diese Untersuchungen muss ein Mischungsverhältnis von 1:10 (1 Teil Natrium-Citrat + 9 Teile Blut) eingesetzt werden. Werden kommerzielle Röhrchen mit Citrat-Vorgabe benutzt, so ist der Markierungsstrich für die Füllhöhe unbedingt zu berücksichtigen! Citrat-Röhrchen und Untersuchungen zur Gerinnungsdiagnostik können Sie bei uns gerne auf Nachfrage erhalten.
BITTE BEACHTEN: Um die Bildung von Mikrogerinnseln zu vermeiden, muss die Probe nach dem Befüllen vorsichtig aber gut geschwenkt werden, um so das Durchmischen des Blutes mit den im Röhrchen enthaltenen Substanzen zu gewährleisten.
Blutausstriche
Bereits wenige Stunden nach der Blutentnahme tritt eine Zellalterung ein, daher sollte zur korrekten Beurteilung des Differenzialblutbildes am besten auch ein Blutausstrich mitgeschickt werden. Dieser ist ebenfalls zum Nachweis von Blutparasiten und hämotropen Mykoplasmen erforderlich.

- einen Tropfen Blut auf das Ende eines Objektträgers geben
- ein Deckgläschen oder Objektträger mit geschliffenen Kanten im 45°-Winkel auf den Objektträger aufsetzen und an den Blutstropfen heranführen
- Tropfen am Deckglas/Objektträger verteilen lassen; Deckglas/Objektträger in einem Winkel von 30 – 45° zügig über den Objektträger schieben und dabei das Blut hinterher ziehen
- Ausstrich lufttrocknen lassen
Wichtig: der Ausstrich sollte
- gleichmäßig sein
- zum ausgestrichenen Ende hin dünner werden
- halbrund auslaufen
Störfaktoren, die zu einer Verfälschung der Ergebnisse führen können
Falls nicht vermeidbar, müssen Störfaktoren wie Hämolyse, Lipämie oder Ikterus bei der Interpretation der Ergebnisse berücksichtigt werden (s. Tabelle 1).
Hämolyse (Schädigung und infolgedessen Auflösung der roten Blutkörperchen) wird meist verursacht während der Probenentnahme oder deren Weiterverarbeitung und ist nur selten krankheitsbedingt. Zur Vermeidung sollte die Vene vor Punktion nur kurzzeitig gestaut werden. Während der Blutentnahme muss ein zu starker Unterdruck in der Spritze vermieden werden um eine Schädigung der Erythrozyten zu verhindern. Wird für die gewünschte Leistung nur Serum/Plasma benötigt, ist es empfehlenswert vor dem Versand den zellfreien Überstand vom Blutkuchen zu trennen. Vollblut sollte nach Möglichkeit nicht versendet werden, da es während des Transportes leicht zu einer Zellschädigung und somit zu einem hämolytischen Serum kommen könnte.
Lipämie (weißliche Trübung des Blutserums/-plasmas) deutet auf fetthaltiges Blut hin. Erhöhte Blutfette liegen in der Regel fütterungsbedingt (oder auch durch starke Belastung) vor und können durch Fasten (6-12 Std.) vor Blutentnahme vermieden werden, sofern dies der Gesundheitszustand des Patienten zulässt.
BITTE BEACHTEN: Keinesfalls darf dem Tier der Zugang zu ausreichend Trinkwasser verwehrt werden!
Ikterus (Gallenfarbstoffe im Blut), oder auch Gelbsucht genannt, ist in der Regel krankheitsbedingt und nicht beeinflussbar.

Lagerung der Blutproben bis zum Transport:
Raumtemperatur
Für die meisten Laboruntersuchungen in Blut, Serum oder Plasma ist die Stabilität einer lichtgeschützten Lagerung bei Raumtemperatur bis zur Abholung oder Versendung ausreichend.
EDTA-Proben für hämatologische Untersuchungen, wie z.B. Blutbilder, sollten stets bei normaler Raumtemperatur gelagert und nicht gekühlt werden. Gleiches gilt für die kurzfristige Lagerung (< 4 Stunden) von Citratblut-Röhrchen für Gerinnungsuntersuchungen.
Kühlschrank (2 bis 8°C)
Darüber hinaus ist mit sehr wenigen Ausnahmen die Lagerung von Serumproben und zentrifugierten Vacutainer-Röhrchen im Kühlschrank zu empfehlen.
Tiefkühlen
Bei einigen Analyten ist eine tiefgefrorene Lagerung der Serum- oder Plasmaprobe nötig. Dies gilt vor allem für Proben, die nicht binnen kurzer Frist in das Labor transportiert werden. Im Leistungsverzeichnis sind solche Proben mit „gekühlt“ bezeichnet. Somit ist das abgetrennte Serum oder Plasma unmittelbar nach der Zentrifugation und Überführung in ein separates Röhrchen einzufrieren. Beispiele für Laboruntersuchungen bei denen die Proben unmittelbar in das Labor transportiert oder tiefgefroren werden müssen: ACTH, pro-BNP, Insulin, ect.
Tiefgefrorene Proben sollen zeitnah versendet werden. Bitte beim Kurierdienst, wenn vorhanden, anmelden und separat mit Kühl-Akkus oder einem sogenannten Versandbehälter für Kühltransport verpacken. (Alle mitgesendeten Behälter schicken wir kostenfrei wieder zurück.)
Achtung:
Das Tiefgefrieren einer Vollblutprobe führt zu einer vollständigen Hämolyse und macht diese unbrauchbar. Das abgetrennte Serum oder Plasma immer zuvor in separate, beschriftete Röhrchen überführen.
Serum und Plasma sind rein äußerlich nicht voneinander zu unterscheiden. Eine entsprechende Beschriftung ist deshalb erforderlich!
Serum-Gewinnung und Zentrifugation
Das Blut 30 Minuten ungekühlt, gut geschwenkt und lichtgeschützt gerinnen lassen.
Empfehlenswert für eine optimale Serumausbeute ist eine stehende Lagerung.
Danach 5 Minuten bei 3500 U/Min. zentrifugieren.
Fehler bei der Serumgewinnung
Zentrifugation zu früh
Erfolgt die Zentrifugation zu früh (nach weniger als 30 Minuten), kann die Gerinnung noch nicht vollständig abgelaufen sein. Dies hat eine Nachgerinnung des Serums zur Folge. Es entstehen Mikrogerinnsel oder das Serum geliert teilweise oder vollständig. Mikrogerinnsel und gelierte Seren können Analysen stören und zu falschen Laborergebnissen führen. Ein Serumgelee muss darüber hinaus im Labor manuell entfernt werden und führt zu Serumverlusten.
Zentrifugation zu spät
Erfolgt die Zentrifugation zu spät (nach mehr als 60 Minuten), kann dies zu Veränderungen von Laborwerten führen. Es kommt zum Beispiel zu einer Reduktion der Glucose und zu einem Anstieg des Kaliumspiegels.
Zu starke Rotation / zu hohe Umdrehungszahl bzw. g-Zahl
Bei zu hoher Geschwindigkeit des Rotors steigt die g-Zahl. Der Druck auf die Blutzellen wird zu stark. Es zerplatzen Erythrozyten und das Serum wird hämolytisch. Es kommt hierbei zu einem Übertritt von Kalium aus den Erythrozyten in das Serum. Die Hämolyse selbst kann Messverfahren beeinflussen und somit falsche Messergebnisse hervorrufen.
Zu geringe Drehzahl oder zu kurze Laufzeit der Zentrifuge
Bei zu geringer Drehzahl oder Laufzeit der Zentrifuge ist die Trennung von Serum und Blutzellen noch nicht vollständig. In vitro können sich Laborwerte verändern und Schwebeteilchen können Analysen stören.
Harnproben
Schicken Sie Urinproben bitte in sterilen und unbeschichteten Röhrchen ein. Die durch Blasenpunktion gewonnenen Harnproben (z.B. Katheterurin) sind Spontanurin vorzuziehen, da hier keine Verunreinigung mit Keimen aus den harnabführenden Wegen, der Körperoberfläche oder der Umwelt vorliegt. Bei der Bewertung der erstellten Befunde muss die Vorgehensweise der Probengewinnung berücksichtigt werden, sie ist deshalb vom Einsender dem Labor mitzuteilen. Wird eine kulturelle (bakteriologische) Harnuntersuchung gewünscht, wird empfohlen zusätzlich zum Urin ein Abstrich vom Harn (Tupfer mit Medium) mitzuschicken, da Urin keimtötende Eigenschaften besitzt.
Lagerung der Harnproben bis zum Transport:
Aufbereitung von Harnproben
Harnproben müssen in sauberen Behältnissen aufgefangen und gekühlt aufbewahrt werden. Die Qualität des Harns als Untersuchungsmaterials ist von der Abnahmetechnik abhängig. Man verwendet am besten Morgenurin, der beim Hund (Ausführen) und bei der Katze (Massieren) zumeist einfach, nötigenfalls auch portionsweise, gewonnen werden kann. Die Harngewinnung erfolgt bei Stute und Kuh durch Katheterisieren. Beim Hengst und Wallach ist man eher auf zufällig gewonnen Harn oder das Auffangen von abgesetzten Harn durch einen am Körper des Pferdes befestigten Harnbeutel angewiesen. Katheterharn darf nur mit sterilen Einmalkathetern entnommen werden. Bei der Hündin und bei Katzen wird Harn auch durch eine Punktion der Harnblase gewonnen.
Anschließend den Harn gut aufrühren und eine kleine Menge in unsere vorgesehene Urinbehälter zum Verschicken abfüllen.
Cortisol/Krea-Quotient
Für diese Untersuchung benötigen wir an zwei aufeinanderfolgenden Tagen abgefangenen Harn.
Achtung:
Hier bitte unbedingt Datum der Entnahme auf die Harnröhrchen notieren.
Transport
Nach vorschriftsmäßiger Abnahme des Morgenharns möglichst tagesgleicher, gekühlter Transport.
Ansonsten Lagerung im Kühlschrank bis 2-8°C, weil sich die Bakterien im Urin bei Raumtemperatur rasch vermehren können und dann zu falsch-positiven Ergebnissen führen.
Kotproben
Nach Möglichkeit sollte die Gewinnung der Proben mit wenig Kontamination erfolgen. Bei vom Boden aufgenommenen Kotproben besteht die Gefahr der Kontamination mit Umweltkeimen. Das Versandröhrchen (steriles, unbeschichtetes Kotröhrchen verwenden; am besten mit Schraubverschluss, da sich durch Gasbildung der Deckel öffnen könnte) sollte mindestens ¼, maximal ¾ gefüllt sein.
Für parasitologische Untersuchungen eignet sich am besten eine Sammelprobe von 3 aufeinanderfolgenden Kotabsätzen, da Parasiten nicht mit jedem Kotabsatz ausgeschieden werden.
Außerdem: Bitte darauf achten, dass eine Kotprobe nicht unter 7° Grad gelagert wird, da sonst ggf. Salmonellen absterben. Dies ist bei einem Darmflora-Screen, Großen/Kleinen Kot-Screen oder Durchfall-Screen relevant.
Da bei Vögeln die Probenmenge stets sehr gering ist und es dadurch zum Austrocknen des Probenmaterials kommen kann, wird die Einsendung eines Kloakentupfers in Transportmedium empfohlen. Sollte ein bisschen Kot an dem Abstrich vorhanden sein, können wir auch hier die parasitologische Untersuchung durchführen.
Tupferproben
Die Wahl des Tupfers richtet sich nach der gewünschten Untersuchung:
- Tupfer mit Transportmedium (Amies) für bakteriologische und mykologische Untersuchungen
Bakteriologische Untersuchungen:
Die Probenentnahme sollte am besten an Stellen erfolgen, die den Erreger mit großer Wahrscheinlichkeit enthalten. Bei eitrigen Entzündungen, Ohrentzündungen und Abszessen wird empfohlen, die Probe am Übergang vom kranken zum gesunden Gewebe zu entnehmen (nicht direkt aus dem Eiter, da dieser vorwiegend aus abgestorbenen Bakterien und Immunzellen besteht). Handelt es sich um eine sehr trockene Oberfläche, an der die Probe entnommen werden soll, so kann der Tupfer vorher mit steriler isotoner Kochsalzlösung angefeuchtet werden, das erleichtert die Probenaufnahme.
Mykologische Untersuchungen:
Sollen Hefen und/oder Schimmelpilzen kulturell nachgewiesen werden, gelten die gleichen Richtlinien zur Materialentnahme wie bei bakteriologischen Untersuchungen (s. oben). Zum Nachweis von Dermatophyten werden allerdings Hautgeschabsel oder Haare benötigt.
- Tupfer ohne Transportmedium für PCR-, virologische und parasitologische und Untersuchungen
Da für virologische Untersuchungen und Untersuchungen auf Chlamydien Zellmaterial gewonnen werden muss, sollten Eiter und andere Sekrete möglichst vor dem „Tupfern“ von der Schleimhaut entfernt werden. Anschließend wird beherzt getupft, um eine ausreichende Zellausbeute zu gewährleisten. Um sicher zu gehen, dass genug Zellmaterial eingeschickt wird, können auch gerne 2 Tupfer verwendet werden.
Hautgeschabsel und Haarproben
Zum Nachweis von Dermatophyten werden Hautgeschabsel oder Haare benötigt. Vor der Probenentnahme wird die Desinfektion der Entnahmestelle mit 70{850629d30786aecef0465c582c44699d7adb12b3e47487e90eff1bd32d4b5dcf}-igem Alkohol empfohlen, um eine potentielle Überwucherung der langsam wachsenden Pilzkulturen mit Bakterien zu beseitigen. Werden Haare eingeschickt, sollten diese an veränderten Hautstellen am Übergang zur gesunden Haut ausgezupft werden (abgeschnittene Haare sind nicht geeignet!).
Bei Verdacht auf Demodexmilben sind mindestens 5 tiefe Hautgeschabsel bis zum Austritt von Blut oder Gewebsflüssigkeit erforderlich oder die eitrig veränderten Haarfollikel müssen ausgepresst werden.
Stehen Sarcoptesmilben in Verdacht, sind verschiedene oberflächliche Hautgeschabsel empfehlenswert. Auch hier ist eine parasitologische Untersuchung möglich.
Je kleiner die eingesetzte Probenmenge ist, desto geringer ist die Nachweismöglichkeit von Hautpilzen oder Parasiten! Bitte achten Sie auf bruch- und verletzungssichere Verpackung und Versand.

